최대 영향 미칠 트렌드로 선정…정밀의학‧RWE‧면역항암제 등 뒤이어
세포와 유전자 치료제가 2024년에 제약업계에 대한 최대 영향을 미칠 산업 트렌드가 될 전망이다.
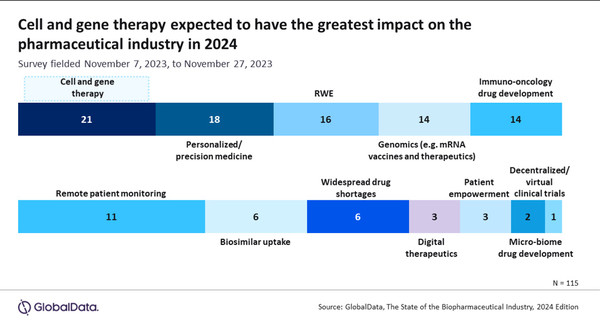
데이터 및 분석 회사인 글로벌데이터가 11월 7일~27일까지 헬스케어 업계 전문가 115명을 대상으로 2024년 제약 산업에 가장 큰 영향을 미칠 산업 트렌드를 조사한 결과, 세포와 유전자 치료제가 톱으로 선정됐다.
업계 전문가들의 18%(21명)는 내년 제약업계에서 세포와 유전자 치료제(CGT)가 가장 중요한 트렌드로 확신하고 있었고, 이어 개인 맞춤/정밀의학(18명, 16%), 실제증거(RWE, 16명). mRNA 백신 등 제노믹스와 면역항암제 발전이 각각 14명으로 뒤를 이었다.
또한 원격환자 모니터링(11명), 바이오시밀러 증가(6명), 약물 부족(6명), 디지털 치료 등을 꼽았다.
세포와 유전자 치료제는 헬스케어 산업 내에서 점점 더 중요한 초점 분야가 되고 있고, 완전한 잠재력은 여전히 실현되지 않고 있다.
2010년 전립선암에 대한 최초의 자가 수지상 세포 치료제인 덴드레온(Dendreon Pharmaceuticals)의 프로벤지(Provenge)의 승인으로 비교적 새로운 영역이지만, 이런 치료제는 유전 질환부터 암에 이르기까지 다양한 복잡한 질병의 치료에 유망함을 보이고 있다.
글로벌데이터는 세포와 유전자 치료제가 향후 수년간 확립된 치료 양상이 될 것으로 예상하고 있지만, 더 높은 개발과 생산 비용, 임상 시험 실패의 위험, 심화되는 가격 및 보험급여 압력은 이러한 혁신에 계속해서 더 큰 부담을 줄 것으로 지적했다.
바이오파마 업계는 아웃소싱을 통해 높은 개발 비용의 상쇄를 시도할 수 있다.
예를 들어, 바이엘은 지난 11월 SPC(Shanghai Pharmaceuticals China)와 세포와 유전자 치료제, 항암제 개발을 위한 첫 번째 중국 연구소를 설립하는 협약을 맺었다.
선진 시장보다 R&D 개발 비용이 저렴하기 때문에, 중국과 같은 국가는 세포와 유전자 치료제 개발을 위한 매력적인 시장이 되고 있고, 따라서 해외에서 만든 세포와 유전자 치료제의 강력한 경쟁자로 부상할 수 있다.
글로벌데이터에 따르면, 2029년까지 전 세계 CGT 시장 규모는 800억 달러에 이를 것으로 전망된다.
종양은 2029년까지 CGT 시장의 44%를 차지해, 세포와 유전자 치료제의 주요 개발 적응증과 영역으로 계속 선두를 이어갈 것으로 예상된다.
글로벌데이터는 세포와 유전자 치료제가 주로 종양 분야에서 사용이 승인됐지만, 이런 치료제의 다양성은 후천성과 유전성 질환 모두에 사용될 수 있음을 의미한다고 밝혔다.
세포와 유전자 치료제로 가장 큰 혜택을 얻을 수 있는 다른 치료 분야는 신경퇴행성, 자가면역, 심혈관 질환 등으로 예상된다.
유전자 편집 시스템 전환점
카스게비(Casgevy) 승인은 혁명적인 유전체 편집 시스템에 대한 중요한 이정표를 가리킨다.
버텍스 파마슈티컬스(Vertex Pharmaceuticals)와 크리스퍼 테라퓨틱스(CRISPR Therapeutics)는 지난달 첫 크리스프(CRISPR) 기반 약물인 카스게비(exagamglogene autotemcel)의 FDA 승인으로, 세포와 유전자 치료제의 역사를 새로 썼다.
지난 11월, 카스게비는 영국 MHRA(Medicines and Healthcare products Regulatory Agency)로부터 겸상 적혈구병과 베타 지중해 빈혈 치료에 크리스프 기반 약물로 첫 승인을 받았다.
12월 8일, 미국 FDA는 겸상 적혈구병의 치료에 카스게비를 신속 승인했다.
이런 획기적인 결정은 첫 유전체 편집 약물을 승인에 의해 새로운 전환점이 됐다.
혁신적인 새로운 치료제는 헤모글로빈 유전자의 오류로 인해 발생하는, 유전성 혈액 장애에 대한 잠재적인 치료를 제공한다.
이전에 혈액 질환에 대한 유일한 영구적인 치료 옵션은 거부 반응 등, 많은 위험을 수반하는 골수 이식이었다.
현재 카스게비는 유일한 마케팅된 크리스프 약물이며, 크리스프 약물 중 유일하게 예비등록과 3상 개발 단계에 있다.
EU에서 겸상적혈구병, 미국과 EU에서 베타 지중해빈혈에 대해 예비 등록에 있다.
또한, 카스게비는 캐나다에서 이런 적응증에 대해 3상에서 평가하고 있다.
반면, 크리스프 약물 파이프라인은 아직 초기 단계에 머물고 있어, 후속 제품의 등장까지는 많은 시간이 필요할 전망이다.
글로벌데이터에 따르면, 1상 임상시험에 비해 2상부터 크리스프 약물이 점진적으로 증가했음에도 불구하고, 개발 초기 단계, 발견, 전임상 단계가 활발한 크리스프 파이프라인 약물의 88%를 차지하고 있다.
이런 비율은 크리스프 약물이 여전히 매우 초기 단계에 있고 더 후기 단계 약물 개발에서 아직 일관되게 확립되지 않았음을 나타낸다고 글로벌데이터가 밝혔다.
현재, 2상 연구는 크리스퍼 테라퓨틱스의 CTX-110 등 24개의 크리스프 약물이 있다.
승인 가능성이 낮고, 후기 단계 제품이 거의 없는 상대적으로 미성숙한 크리스프 약물 파이프라인을 고려할 때, 가까운 미래에 다른 약물 승인을 보기는 어려울 것이라고 글로벌데이터가 밝혔다.

