"진행성 병기도 동일한 생존 연장 효과" 평가
유일한 간세포암 표적치료제였던 넥사바(성분명 소라페닙)가 출시된 이후 10년만의 새로운 약제 등장으로 간암 치료의 새로운 기전을 마련했다는 평가다.
넥사바 투여 이후 새로운 치료 방법이 없던 간암환자들에게 2차 치료제가 투여가 가능하게 됐다.
17일 플라자 호텔에서 열린 스티바가 2차 치료 허가 기자간담회에서 김도영 신촌스란스 교수는 "간암은 초기에 발견됐을 경우 치료를 위해 수술을 하는 것이 기본이며 초기에 발견해야만 간이식이 가능하다"면서 "중기 이후에는 경동맥치료나 전신요법으로 넥사바를 써왔는데 넥사바로 치료해도 소용이 없는 환자들은 스티바가로 치료가 가능하게 됐다"고 말했다.
김도영 교수는 "수술은 절제로 완치가 가능하나 5년 재발율이 75%에 이른다. 간이식의 경우도 수술보다 조금 높은 70~80%대의 5년 생존율을 보있다"면서 "현재 임상 현장에서는 색전술에 의존하지 말고 넥사바로 넘어가자는 움직임이 있다. 경동맥화학색전술 불응 환자에게 넥사바를 쓰자는 의견이 높아지고 있다"며 경구약제 치료에 선호도가 높아지고 있음을 나타냈다.그는 "절제 불가능한 환자를 대상으로 넥사바와 스티바가(연속된 치료법)를 쓰면 전체 생존율을 26개월 보인다"면서 "이는 중간 병기 최적인 환자들의 생존 기간"이라고 소개했다.
이어 "임상 결과는 색전술이 불가능한 환자들에게 사용한 것이기 때문에 생존 연장이 의미있게 길었다는 것을 보여줬다"면서 "스티바가가 진행성 병기도 동일한 생존 연장이 나타난 것은 현재까지 치료의 어려움을 겪고 있던 진행성 환자에게 희망을 주는 결과"라고 평가했다.그는 마지막으로 "스티바가가 간암환자들에게 새로운 희망이 되고 많은 혜택을 주었으면 하는 것인 개인적인 희망"이라고 말했다.
임호영 교수는 "임상현장에서는 넥사바를 빠르게 사용하는 시기가 됐다"면서 "두 약제를 차례로 사용한 결과 생존율이 증가한 것은 연속으로 사용하기 때문에 넥사바의 사용 시점이 빨라져 치료 기간이 늘어났기 때문"이라고 분석했다.
부작용에 대해서는 "넥사바를 쓰면서 약에 적응이 되서 그런 측면이 있겠지만 전반적으로 넥사바 보다 스티바가가 부작용에서 좋은 면을 보였다"면서 "임상 현장에서도 환자들이 넥사바 보다 수월하게 약을 복용하는 것을 보고 있다. 현장에서도 그대로 적용될 듯 하다"고 평가했다.앞서 이날 기자간담회에서 잉그리드 드렉셀 바이엘 대표는 "기존에 유일했던 간세포암 표적 치료제 넥사바에서 스티바가에 이르기까지 바이엘이 간세포암 치료의 파이프라인을 탄탄히 다지게 되어 기쁘다"면서 "바이엘은 최초로 전체 생존 기간을 유의하게 개선한 표적 치료제 스티바가를 통해 전세계 간세포암 치료의 패러다임을 혁신적으로 바꿔나갈 것"이라고 말했다.

올해 4월 FDA와 6월 일본후생노동성으로부터 소라페닙 치료 경험이 있는 간세포암 환자 2차 치료제로 허가 받았다.
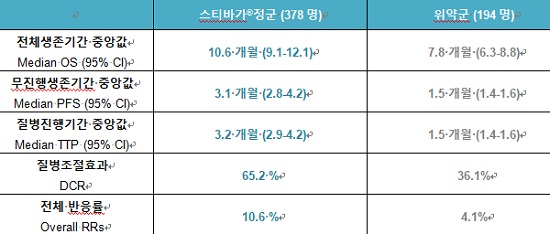
스티바가의 간세포암 2차 치료제 허가 배경이 된 RESORCE(Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment)는 전세계 21개국 152개 지역에 소라페닙으로 1차 전신치료를 수행했음에도 질병이 진행된 간세포암 환자를 대상으로 스타바가의 유효성 및 안전성을 평가한 다국적, 다기관, 무작위, 이중맹검, 위약대조 3상 임상 연구다.RESORCE에서 전체 생존기간(OS)은 스티바가의 경우 10.6개월을 위약군은 7.8개월을 보였고, 무진행 생존기간(PFS)은 스티바가가 3.1개월, 위약군이 1.5개월을 보였다.
스티바가 치료군에서 가장 흔하게 나타난 이상 반응은 고혈압, HFSR, 피로감, 설사였다.
