‘렘데시비르’ 'mRNA-1273' 등 초기 유망…‘하이드록시클로로퀸’ 등 실망
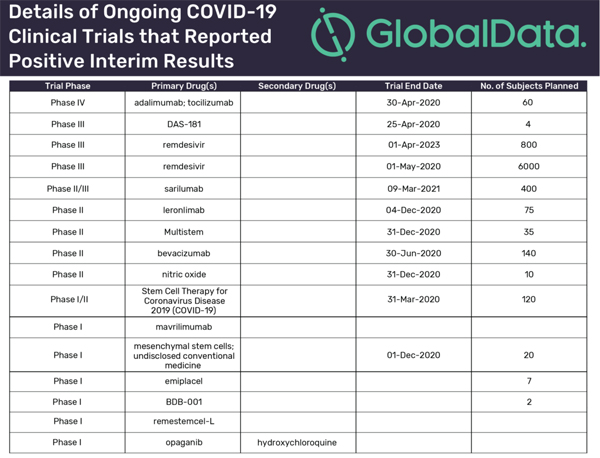
컨설팅 업체인 글로벌데이터에 따르면 지금까지 21개 진행하는 코로나19 임상시험이 중간 결과를 보고했고, 이 중 17건에서 긍정적 초기 결과를 보였다.
대부분 이런 임상은 코로나바이러스가 유행을 시작한 직후인 올해 초 시작됐다.이런 임상은 코로나19에 대한 치료의 효과에 대한 더 많은 데이터를 제공할 것으로 예상되는 2020년 4월~2021년 3월 사이에 종료 데이터들이 나올 것으로 추정된다.
긍정적 데이터를 보인 연구 중 3건은 미국 FDA에서 긴급사용허가를 받은 길리어드 사이언스의 렘데시비르(remdesivir), 모더나의 후보 백신 mRNA-1273 등이다.긍정적 결과를 보인 임상은 69%가 1상~2상 연구 등 초기 단계에 있다.
그 중 대다수는 2차 중재를 이용한 단독 혹은 복합 치료 등 다른 약물을 시험하고 있다.가장 많은 환자 등록을 계획하고 있는 4개의 다국적 임상시험은 렘데시비르, 사릴루맙(sarilumab), 베바시주맙(bevacizumab)을 조사하고 있다.
최근 긍정적 연구 결과를 보인 약품 중 하나는 렘데시비르이다.심각한 코로나19 환자에 대한 렘데시비르의 안전성과 효능을 평가하는 길리어드 사이언스의 임상 3상 진행 임상 결과는 지난 4월 29일에 발표했다.
렘데시비르는 5일 치료를 받고 있는 환자와 10일 치료를 받고 있는 환자에서 비슷한 임상적 개선을 입증했다.환자의 절반 이상이 두 치료 그룹에서 14일까지 퇴원했고 임상적 회복도 달성했다.
후보 약품은 두 목적 그룹에서 우수한 내약성을 보였다.임상에서 위약군에 비해 회복 기간이 31% 더 빨랐다고 보고했다.
또한 회복 기간은 렘데시비르 그룹은 11일 반면, 위약군은 15일이었다.
모더나(Moderna)는 코로나19 백신 후보 mRNA-1273에 에 대한 첫 1상 임상시험에서 항체가 형성되는 긍정적 결과를 18일 발표했다.
NIAID(National Institute of Allergy and Infectious Diseases)에가 주도하는 임상에서 mRNA-1273 3가지 용량(25, 100, 250mcg) 수준에서 45명 환자 모두 면역원성이 증가했다.
모더나는 백신 후보물질을 두 번째 투여한 후 약 2주가 지난 뒤 25㎍ 그룹에서 코로나19에서 회복된 사람과 비슷한 수준의 항체가 형성됐다고 설명했다.
100㎍ 그룹에서는 코로나19에 감염됐다가 회복된 사람을 능가하는 수준의 항체가 생성됐다.
또 최소 8명명이 바이러스를 무력화하는 중화항체(neutralizing antibodies)도 형성됐다.
모더나는 지난 7일 미국 FDA에서 mRNA-1273의 2상 임상시험을 승인받았고 조만간 600명을 대상으로 연구를 시작할 예정이라고 밝혔다.
사릴루맙은 레제너론 파마슈티컬과 사노피가 공동 개발하는 류마티스 관절염 치료제이다.
이는 코로나19 환자에서 과잉 염증 반응에 중요 역할을 하는 것으로 알려진 IL-6(interleukin-6) 경로를 억제하는 단클론항체이다.로슈의 아바스틴으로 판매하는 베바시주맙은 VEGF(Vascular Endothelial Growth Factor) 억제제이다.
VEGF는 코로나19 환자에서 더 높은 수준으로 관찰되고 있다.모든 약품이 긍정적 결과를 보이지 않았다.
미국 도날드 트럼프 대통령이 면역억제제로 권고한 하이드록시클로로퀸(Hydroxychloroquine)은 후향 연구에서 최근 최종목표에 도달하지 못했고 부작용을 보고했다.그럼에도 불구하고 1차 혹은 2차 약품으로 하이드록시클로로퀸 혹은 클로로퀸을 조사하는 많은 연구들이 계속 확대되고 있다.
효능과 안전성에 대한 초기 부정적 결과를 보인 2건의 임상시험이 있다.하나는 코로나19 치료에 다루나비르(darunavir)와 코비시스타트(cobicistat)에 대한 안전성과 효능을 평가하는 임상 3상 연구이다.
다른 연구는 심각한 급성 호흡기 증후군으로 입원 환자의 치료에 대한 클로로퀸의 임상 2상이다.두 임상시험은 오는 8월말에 종료가 예상된다.
다루나비르는 프리지스타(Prezista)란 브랜드로 J&J와 다른 회사에서 다른 제품명으로 마케팅되는 HIV 치료제이다.코비시스타트는 길리어드가 티보스트(Tybost)란 브랜드로 마케팅하는 HIV 치료제이다.
다른 후보 약품은 △하기도 파라인플루엔자(parainfluenza) 바이러스 감염으로 입원한 면역 손상 환자에 대해 개발 중인 안선 바이오파마(Ansun Biopharma)의 실험 약물 DAS-181, △사이토딘(CytoDyn)의 HIV 약품 레론리맙(leronlimab), △아테시스(Athersys)의 신경, 염증, 면역과 심혈관 질환에 대한 줄기 세포 치료제 멀티스템(MultiStem), △말린크로드트(Mallinckrodt)의 이노맥스(INOmax) 등 산화 질소, △과립구 대식세포 집락자극인자 수용체 알파를 표적으로 하는 항체인 키닌사 파마슈티컬(Kiniksa Pharmaceuticals)의 마브릴리우맙(mavriliumab) 등이 있다.현재 많은 코로나19 임상시험은 유망한 초기 결과를 보여주지만, 최종 데이터가 보고됐을 때 결론을 도출할 수 있다.
597건의 계획된 임상실험고 함께, 앞으로 몇 달 안에 전망을 할 수 있는 더 많은 데이터가 나올 것이고 코로나19 치료를 위한 주요 약물 후보가 나올 가능성이 있다.WHO와 미국 임상시험 등록기관인 ClinicalTrials.gov에 따르면 현재 코로나19 치료에 진행 중인 임상시험은 1114개가 있다.