빠른 출시가 기업 가치 높여
기업의 가치를 높일 알짜 파이프라인을 찾는 가장 쉬운 방법은 혁신치료제나 우선심사 지정을 받을 가능성이 높은 제품을 찾아내는 것이 좋은 대안으로 떠오르고 있다.
혁신 제품이 미충족 의료수요가 높은 제품일수록 혁신치료제(BTD)지정 및 우선심사(priority review) 대상으로 지정될 가능성이 높아진다.
또한 신제품 허가 속도가 빠를수록 이른 출시가 가능해져 경쟁에 유리하기 하게 되는것이다. 따라서 신속한 제품 출시로 인한 실적 고성장이 기업가치 재평가로 이어져 가치를 높이는 긍정적 결과로 연결되는 것으로 나타났다.
최근 미국 FDA의 의약품 심사 속도가 빨라지고 있다.
의약품의 일반 심사기간이 2010년 23개월에서 2019년에는 12개월 소요로 감소한 것으로 나타났다.
우선 심사 기간도 지속적으로 낮아지며 지난해 기준 8.5개월을 기록했고, 혁신치료제(BTD)는 6.3개월이 소요됐다.
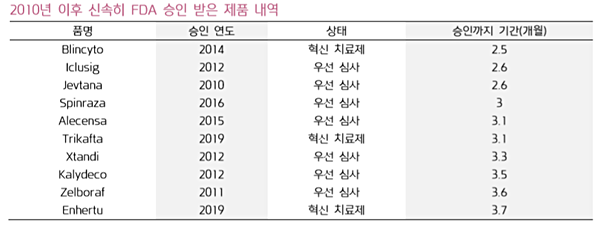
실제 지난해 혁신치료제로 선정된 버텍스의 낭성섬유증치료제 ‘트리카프타(Trikafta)’는 승인 신청부터 허가까지 불과 3.1개월이 소요됐고, 아스트라제네카와 다이이찌산쿄의 유방암치료제 ‘엔허투(Enhertu)’는 3.7개월로 굉장히 빠른 시일 내 승인을 받았다.
버텍스는 치료대안이 없는 낭포성섬유증 치료제 신약 트리카프타를 예상보다 5개월 앞서 최초 FDA 승인을 받은 후 출시 2달 만에 시장 기대치($ 70mn) 보다 6배 높은 $420mn을 기록했다. 더욱이 지난해 10월 21일 승인 이후 버텍스의 주가는 31% 상승한 것으로 나타났다.
다이이찌산쿄가 아스트라제네카에 지난해 3월 $6.9bn(약 7.8조원)에 기술 수출한 유방암치료제 엔허투(Enhertu)는 예정보다 두 달 빠르게 허가를 받고 지난 1월 출시했다.
다이이찌산쿄 주가는 기술 수출 이후부터 지속적으로 상승해 현재까지 50% 이상 향상됐다.
이에 대해 증권가는 “대규모 기술수출 금액, 우수한 데이터, 신속 출시 등의 영향이 있었으나, 기술 수출 이후 모멘텀 종료로 인식된 국내 시장과는 상이한 결과”라며 “기술 수출 이후에도 데이터로 글로벌 블록버스터 신약 가능성을 얼마나 빠르게 보여주느냐가 중요해 보인다”고 평가했다.
한편 국내 업체 중 우선심사를 획득한 곳은 아직까진 없으나, 큐리언트의 다제내성결핵치료제 Q203이 2b상 완료 후 신청을 목표로 하고 있다.
혁신치료제(BTD)는 국내에서 한미약품의 폐암치료제 올리타(HM61713)가 2015년 12월에 받았으나, 경쟁약물인 타그리소의 선전으로 3상 환자 모집이 어려워 개발 중단된 바 있다.
또한 신속하게 임상 속도를 내고 있는 물질은 유한양행의 레이저티닙과 JNJ-372 병용 임상으로, 2018년말 얀센에 기술 수출 후 올해 상반기 1b상 종료 및 하반기 2상 진입이 예상된다.
증권가는 1b상 결과에 따라 2/3상이 진행된다면 임상 기간을 단축할 수 있을 것으로 내다봤다.

