로슈, ‘티쎈트릭’ 진행 질병 첫 약품…‘키트루다’ 추격, ‘옵디보’ 실패
점점 더 복잡해지는 체크포인트 억제제 경주에서 소세포암 치료에 경쟁 열기가 달아오르고 있다.
소세포폐암은 두 번째 진입한 로슈가 확고한 리더인 머크(MSD), BMS를 앞서고 있는 드문 분야이다.하지만 MSD가 최근 PD-1 스타를 승인을 받아 이 시장에서 경쟁을 예고하고 있다.
MSD는 백금 기반 화학요법과 최소 하나의 앞 라인 치료에 대해 혹은 후 질병이 진행된 전이성 소세포폐암 환자의 1차라인 치료에 단독요법으로 키트루다(Keytruda)를 최근 미국 FDA에서 신속승인을 받았다.회사는 이런 소세포폐암에 PD-1 억제제의 첫 승인이라고 밝혔다.
이런 적응증에 키트루다의 승인은 KEYNOTE-158, KEYNOTE-028 연구의 데이터를 근거로 했다.올해 초 발표한 결과에서 키트루다는 2명 완전 반응과 14명 부분 반응 등 83명 참가자 중 19.3%의 전체 반응률을 보인 반면 반응 지속은 반응자의 56%에서 18개월 이상 지속됐다.
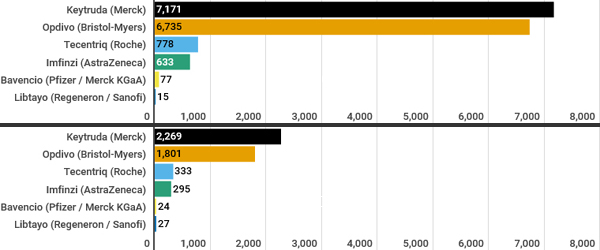
반응한 16명 사이에서 종양의 63%가 1년 이상 동안 키트루다에 반응을 지속했다.키트루다는 1분기 매출 23억 달러로 전년동기대비 55% 급증했다.
전체 폐암의 10~15%를 차지하는 소세포폐암은 예후가 매우 나쁘고 역사적으로 제한된 치료 방법이 있는 진행 단계에서 진단되는 경우가 많다.그렇기 때문에 이 분야에서 로슈의 성공은 획기적인 성과로 평가받고 있다.
지난 3월 티쎈트릭(Tecentriq, atezolizumab)과 화학요법(carboplatin/etoposide) 복합이 1차 라인 사용에 승인됐을 때 소세포폐암이 퍼진 치료받지 않은 환자에게 20여년 만에 처음으로 새로운 옵션을 마련했다.이 분야에서 개선의 절박한 필요성을 강조하면서, 티쎈트릭 복합요법은 사망 위험 30% 감소와 함께 중앙 전체 생존율은 화학요법 단독요법 10.3개월에 비해 12.3개월로 연장을 보였다.
위험비율 0.77과 함께 무진행 생존은 대조군 4.3개월에 비해 티쎈트릭 그룹은 5.2개월이었다.로슈의 티쎈트릭은 새로 진단된 소세포폐암 환자의 치료에 FDA에서 승인된 첫 면역항암제이다.
반면 BMS의 PD-1 억제제 옵디보(Opdivo, nivolumab)는 질병이 백금 기반 화학요법과 최소 하나의 다른 라인 치료 후 진행된 전이성 소세포폐암 환자에게 작년 FDA에서 신속 승인을 받았다.승인은 환자의 12%가 PD-L1 발현과 상관없이 옵디보 치료에 반응했고 중앙 반응 기간은 17.9개월을 보인 데이터를 기반으로 했다.
그러나 이후에 BMS는 옵디보가 백금 기반 화학요법 후 재발된 소세포폐암 환자에서 현재 표준요법에 대해 유의미한 전체 생존연장에 실패했다고 보고했다.현재 옵디보는 같은 적응증에 최대 라이벌인 키트루다에 대해 일부 공간을 만들어야 할 것으로 보인다.
1분기 옵디보의 매출은 18억 달러를 기록했다.
고재구 기자
news@pharmstoday.com

