희귀약·항암제 대다수 차지…8개 중 1개 임상3상없이 OK
2018년 미국 FDA에서 승인된 신약의 약 절반이 하나의 임상시험에 의존한 것으로 나타났다.
2014년 JAMA에 게재된 연구에 따르면 3005~2012년 사이에 미국 FDA는 206개 적응증에 188개 새로운 치료제를 승인했고 이 중 74개 적응증(36.8%)는 단 하나 중요 임상의 근거로 승인됐다.최근 IQVIA의 보고서를 보면 2018년 FDA에서 승인된 59개 신약 중 25개(42%)가 단 하나 임상을 근거로 허가됐다.
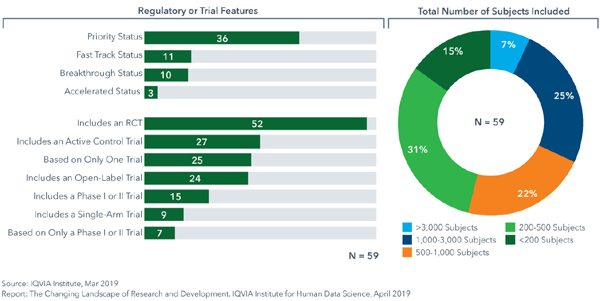
하지만 예년처럼 단 하나 임상실험에만 의존하는 약품의 상당 부분은 새로운 희귀약과 항암제였다.
아스트라제네카의 희귀약 루목시티(Lumoxiti)는 드물고, 느리게 진행되는 혈액암이 있는 100명 미만 환자의 한 임상시험을 근거로 2018년 9월 승인됐다.스템라인 테라퓨틱스(Stemline Therapeutics)도 미국에서 94명 환자에 대한 한건의 임상시험 후 드문 골수와 혈액암 치료에 엘존리스(Elzonris)를 작년 12월에 청신호를 받았다.
반면 다른 항암제들은 보다 큰 규모 단일 임상 후 승인됐다.
화이자의 비짐프로(Vizimpro)는 아시아에서 진행성 비소세포폐암이 있는 452명 환자에 대한 하나 임상시험을 근거로 작년 9월에 승인됐다.어레이 바이오파마(Array Biopharma)의 브라프토비(Braftovi)는 진행됐거나 수술로 제거할 수 없는 BRAF V600 변이 양성 흑색종 환자 383명을 대상으로 실시한 한 임상 결과로 2018년 6월 허가됐다.
임상은 유럽, 북미 등 162개 사이트에서 실시했다.AAA(Advanced Accelerator Applications)의 루타테라(Lutathera)는 미국과 7개 서구 유럽국가의 41개 사이트에서 드문 종양의 특이형 환자 229명의 하나 임상을 근거로 승인됐다.
하지만 2018년 한 개 임상을 근거로 승인된 모든 신약은 항암제만이 아니었다.
파라텍 파마슈티컬(Paratek Pharmaceuticals)은 아시아, 유럽, 이스라엘, 라틴 아메리카, 남아프리카, 미국의 86개 사이트에서 지역사회 인수 박테리아 폐렴(CABP) 환자 774명의 단일 연구를 근거로 2018년 10월에 항생제 뉴지라(Nuzyra)를 승인받았다.
고재구 기자
news@pharmstoday.com

