절반 이상 희귀병 OK…첫 RNAi 약품 허가
또한 FDA는 제네릭 등 많은 다른 약품도 허가했다.
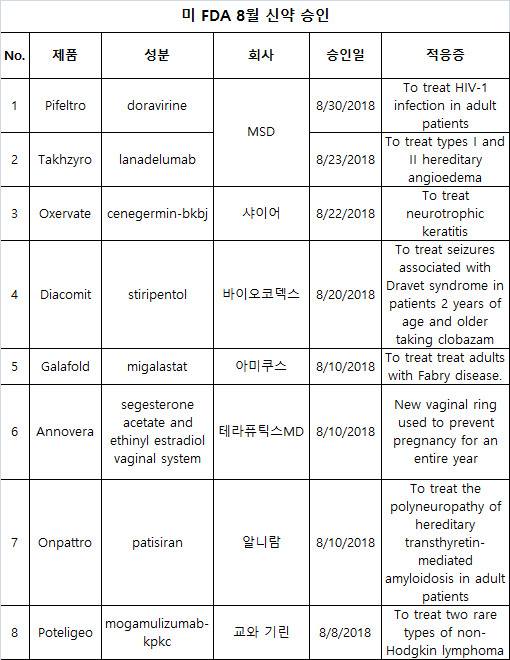
8월에 승인된 첫 신약은 일본 교와 기린의 포텔리지오(Poteligeo, mogamulizumab-kpkc)였다.이 약품은 비호지킨 림프종의 두유형인 재발/난치성 용상진균증(mycosis fungoides) 혹은 세자리 증후군(Sézary syndrome) 성인 환자의 2차 라인 치료에 사용된다.
알니람의 온파트로(Onpattro, patisiran)는 hATTR(hereditary transthyretin-mediated) 아밀로이드증의 다형성증 치료에 청신호를 받았다.이는 첫 RNAi 치료제로 승인이다.
아미쿠스 테라퓨틱스는 패브리(Fabry) 병 치료에 첫 경구 약품인 갈라폴드(Galafold, migalastat)를 승인받았다.FDA는 테라퓨틱스MD의 피임약 안노베라(Annovera)를 허가했다.
안노베라(segesterone acetate/ethinyl estradiol vaginal system)는 첫 처방 장기지속 피임기구이다.프랑스 바이오코덱스는 이미 클로바잠(clobazam)으로 치료받는 2세 이상 환자의 드라벳 증후군(Dravet syndrome) 관련 발작 치료에 다이아코미트(Diacomit, stiripentol)를 승인받았다.
이탈리아의 돔페는 심각한 안질환인 신경영양 각막염 치료에 옥세바트(Oxervate)의 청신호를 받았다.샤이어는 12세 이상 유전성 혈관 부종의 예방에 탁지로(Takhzyro, lanadelumab-flyo)를 허가받았다.
희귀약인 탁지로의 승인은 다양한 최종 임상에서 효능을 입증한 데이터를 근거로 했다.가장 최근 FDA의 승인을 머크(MSD)의 2개 HIV-1 치료제 피펠트로(Pifeltro)와 델스트리고(Delstrigo)이다.
피펠트로는 비 뉴클레오시드 역전사효소 억제제이고 델스트리고는 3개 약품 단일 복합제이다.
고재구 기자
news@pharmstoday.com

