톱 셀링 바이오로직 특허만료…복잡한 승인과정, 특허소 등 걸림돌
톱 셀링 약품들의 바이오시밀러들이 미국 FDA에서 승인됐지만 마케팅이 지연되고 있다.
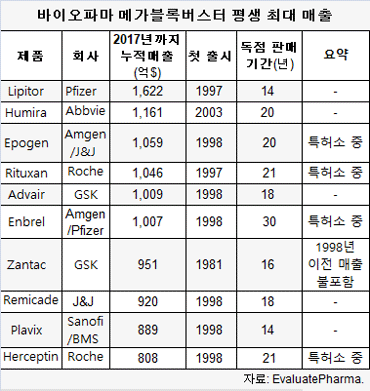
미국 FDA의 비평가들은 경쟁 부족과 그 결과 더 비싼 약가에 대한 주요 이유 중 하나로 FDA의 복잡하고 난해한 승인 과정을 오랫동안 지적했다.사례는 2018년 예상된 선두주자이고 2017년과 2016년에 확실한 매출 톱인 애브비의 휴미라(Humira)이다.
미 바이오시밀러 승인FDA는 베링거인겔하임의 실테조(Cyltezo)와 암젠의 암제비타(Amjevita) 등 이미 2개 휴미라 바이오시밀러를 승인했다.
5위인 아바스틴(Avastin)의 바이오시밀러인 엠바시(Mvasi)도 2019년 초까지 미국에서 마케팅되지 않을 것으로 예상된다.
7위인 허셉틴(Herceptin)의 바이오시밀러인 오기브리(Ogivri)는 작년 12월 허가됐지만 출시일은 알려지지 않았다.반면 8위인 레미케이드(Remicade)는 FDA에서 2개 바이오시밀러 경쟁약품이 승인됐고 판매되고 있지만 시장의 약 5% 점유로 이용은 느리다.
출시된 바이오시밀러는 2015년 미국에서 승인된 뉴포젠(NEUPOGEN) 바이오시밀러인 작시오(Zarxio)이다.전문가들은 높은 손해 배상 위험이 제품을 출시하기 전에 많은 바이오시밀러 기업들이 특허 해결을 기다리는 원인으로 지적했다.
특허는 12년 독점기간 동안 제기되는 만큼 승인부터 위험이 적은 출시를 허용할 수 있어 이런 문제는 시간이 지나면 해결될 수 있다.유럽 시장
미국과 대조적으로 유럽 바이오시밀러 시장은 톱 10 리스트에서 경쟁을 위해 바이오시밀러의 더 신속하고 빠른 이용을 보이고 있다.
엔브렐의 바이오시밀러는 29% 시장 점유를 보이고 있고 미국에서 아직 승인되지 않았지만 곧 청신호를 받을 리툭산(Rituxan)의 바이오시밀러는 13% 시장 점유를 기록했다.
오리지널 매출유럽 마케팅 파트너인 머크(MSD)의 레미케이드 매출은 2017년 8.37억달러로 2016년 12.7억달러에 비해 34% 급감했다.
반면 미국 마케팅 담당인 J&J의 레미케이드 매출은 2017년 63.1억달러로 전년대비 9.3% 감소했다.
암젠의 엔브렐 매출은 2017년 54.3억달러로 전년대비 9% 하락했다.회사는 판매가 인하와 수요 감소로 매출이 줄었다고 설명했다.
암젠의 뉴포젠은 작년 매출이 5.5억달러로 전년대비 28% 떨어졌다.로슈의 리툭산(MabThera/Rituxan) 매출은 2017년 73.9억 CHF로 전년대비(73억 CHF) 1.2% 증가에 머물러 바이오시밀러 영향권에 든 것으로 나타났다.
고재구 기자
news@pharmstoday.com

