미 FDA, 역대 최대 77건 허가…476건 지정
2017년 새로운 성분약과 바이오로직 승인과 기존 약품의 희귀질환 적응증 승인 등 미국 FDA의 희귀약 지정과 승인은 이전 해와 비교해 급증했다.
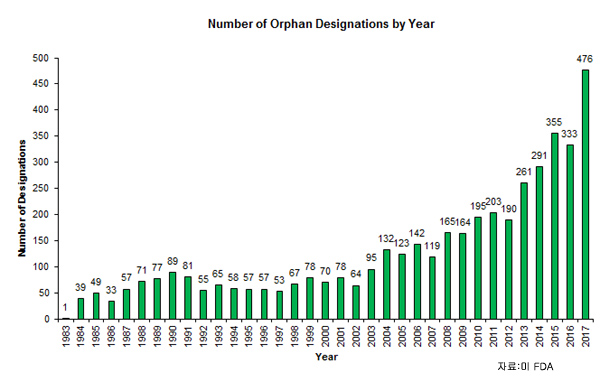
작년 FDA는 77개 희귀약 승인과 476건 지정 신청을 허가했다.이는 2014년 49개 희귀약 승인과 2015년 355개 지정 신청 허가보다 증가했다.
희귀약 지정 증가는 계류 중인 지정 신청의 병목을 없애기 위한 목적인 FDA의 ‘OOPD(Orphan Drug Designation Modernization Plan)’의 결과이다.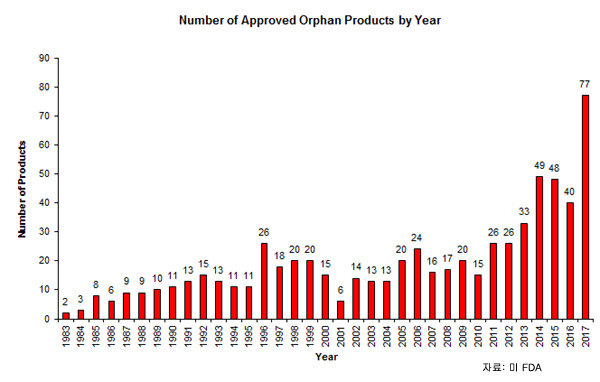
1983년 이후 FDA는 650여개 희귀약을 승인했고 약 4500개 희귀약 지정을 허가했고 6500여개 희귀약 지정 신청을 받았다.
최근 FDA는 더 효과적으로 희귀약 지정 신청을 위한 시험적 계획을 도입한다고 밝혔다.시험적 계획의 요소는 신청 과정을 통해 스폰서들을 안내할 온라인 지침으로 FDA 검토 과정을 더 효율적이고 스폰서들에게 지정 과정을 더 쉽게 하기 위한 내용과 FDA의 커뮤니케이션 과정을 유연하고 표준화하기 위한 새로운 컨설팅 과정 등이다.
최근 M&A에 의해 입증된 빅 파마는 지난 수년간 희귀약 시장을 더 중요하게 여기고 있다.
일례로 사노피는 희귀 혈액 질환에 대한 연구에 초점을 둔 바이오텍인 바이오베라티브를 120억달러에 인수했다.
컨설팅업체인 EvaluatePharma는 희귀약 시장은 2017년 1270억달러에서 2022년 2170억달러 규모로 약 2배 성장을 예상했다.톱 희귀약은 매출 38억달러 이상인 테바의 코팍손(Copaxone), 알렉션의 솔리리스(Soliris, 매출 32억$), 샤이어의 애드바트(Advate, 23억$), 바이오젠의 아보넥스(Avonex, 22억$), 머크 KGaA의 레비프(Rebif, 18억$) 등이다.
2건의 가장 중요한 케이스는 아데노신 데아미나아제 결손증에 대한 유전자 치료제인 GSK의 스트림벨리스(Strimvelis)와 바이오마린의 바텐병 치료에 유일한 효소대체 치료제인 브리뉴라(Brineura)이다.
고재구 기자
news@pharmstoday.com

