품질, 공정관리 설명서 등 문제 주요인…안정성 이슈 최다
품질, 공정관리와 설명서 문제의 증가가 백신 제조 위반 보고의 증가 원인이라고 미국 FDA가 밝혔다.
FDA는 유통된 제품의 안전성, 순도, 효능이 영향을 받는 허가된 생물학적 제제나 혈액 혹은 혈액 성분의 제조와 관련된 어떤 요건을 요구하고 있다.지난주 발표한 FDA 보고서에 따르면 혈액과 혈액 성분보다 다른 생물학적 제제의 허가를 받은 제조업체들은 2016년 전년대비 17% 증가한 651건의 생물학적 제제 위반을 보고했다.
전년대비 19% 증가한 보고의 40%(256건)는 백신 메이커가 제출했다.이런 우려된 백신의 최대 수는 안정성 실패 28건을 통해 제품 설명서를 충족하지 못한 경우였다.
반면 품질관리와 유통과 관련한 보고 건수는 2015년 30건에서 2016년 46건으로 증가했다.이는 대부분이 바이알이 부서지거나 파손된 것과 관련이 있었다.
공정관리와 관련된 위반 보고는 40건으로 2배 증가한 반면 안정성 시험을 부정하게 실시하거나 실시하지 않은 시험과 관련된 보고는 연간 43건에서 21건으로 감소했다.
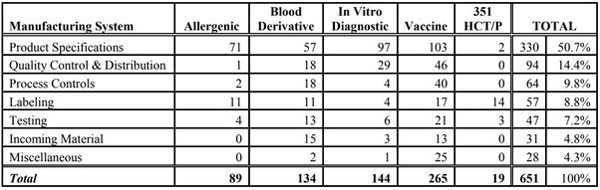
2016년 미 FDA 백신 제조위반 보고 건수

